


Come cittadini e consumatori della società occidentale siamo abituati a trovare sul mercato prodotti espressamente disegnati per incontrare i gusti personali e/o per soddisfare nostre specifiche o presunte necessità. Tale esigenza di personalizzazione è oggi avvertita anche nel settore dei prodotti per la salute e il benessere. Ma cosa sono le “medicine e terapie personalizzate”? Come possono essere realizzate e con quali obiettivi terapeutico-sanitari?
Secondo la definizione più comune
(Dir. 2001/83/EC*), un farmaco è
“una qualsiasi sostanza o combinazione
di sostanze impiegata nella prevenzione,
cura e diagnosi di una malattia”.
Di solito, il medicinale contiene
un farmaco o principio attivo (p.a.) in
un dosaggio preciso e definito perché
esso sia efficace e, per quanto possibile,
non tossico.
La presentazione del
farmaco nella sua forma finita e pronta
all’uso da parte del paziente (o dell’operatore
sanitario), il medicinale
appunto, è il risultato di un processo
tecnologico che, partendo dal principio
attivo, lo trasforma in una forma
idonea alla somministrazione. Questa
trasformazione è essenziale perché
qualsiasi sostanza farmacologicamente
attiva possa avere un effettivo impiego
clinico, con garanzia per il paziente di
efficacia, sicurezza, qualità e, non ultimo,
di “accettabilità”.
Volendo ordinare questi quattro valori
secondo un criterio di importanza,
si potrebbero ritenere i primi due
imprescindibili rispetto ad aspetti più
“consumistici” come la qualità del
prodotto o l’indice di gradimento
associato al suo utilizzo. In realtà nell’era
moderna appare superata una
visione secondo la quale il medicinale
o la terapia debbano sostanzialmente
risolvere/stabilizzare una condizione
patologica, accettando che ciò possa
essere accompagnato da un disagio o,
peggio ancora, da un effetto secondario
più o meno grave. Soprattutto per
terapie non salvavita, è sempre più difficile
accettare “una medicina cattiva,
purché faccia bene” e questo per varie
ragioni. E’ cambiato il panorama
sociale (ed economico) all’interno del
quale il medicinale si colloca come
“prodotto per la salute e per il benessere”.
E’ aumentato il valore intrinseco
attribuito al medicinale sia da parte di
chi lo produce che da parte di chi lo
utilizza. Nei paesi avanzati si consumano
sempre più prodotti (medicinali
e non) per rispondere al generale
desiderio di uno stato di salute e di
benessere ottimali.
Con la facilità di
diffusione e scambio di informazioni
garantita dagli attuali mezzi di comunicazione,
il paziente/consumatore ha
acquisito maggiore consapevolezza
relativamente ai prodotti che assume,
riconoscendone il valore e la necessità
del loro corretto utilizzo. Per questo
egli appare più responsabile e partecipe
nell’ambito della terapia e diventa
esigente verso il medicinale e verso
coloro che lo prescrivono e/o consigliano.
Pertanto, avanzamento tecnologico ed
innovazione farmaceutica, orientati da
sempre al miglioramento della salute
pubblica, oggi non possono trascurare
il concetto di “patient care”, inteso
come necessità di disegnare le nuove
terapie “su misura” del singolo paziente,
in relazione ai suoi bisogni e al suo
grado di coinvolgimento nella terapia
(convenience e compliance). Da questo
punto di vista, il bisogno di innovazione
e di nuove tecnologie diventa
pressante, laddove “caring about the
patient/user” significa riconoscere che
ciascuna categoria di pazienti è speciale
(bambini, anziani, donne in gravidanza,
obesi, popolazioni del terzo
mondo, animali, etc..) e che non
necessariamente essa trarrà beneficio
da un prodotto studiato per funzionare
sul paziente medio.
In che senso ogni paziente è speciale?
La diversità dei pazienti esiste innanzitutto
sulla base di fattori oggettivi di
tipo genetico (ereditari o meno), fisiopatologico,
metabolico, associati al
genere, razza, età, stato fisico dell’individuo.
Queste variabili di solito non
sono controllabili da parte del paziente,
ma possono determinare risposte
diverse alla stessa terapia.
Ulteriori elementi di diversità sono
invece di natura soggettiva e sorgono
nell’ambito della sfera psicologica
della persona. Essi sono determinati
dal carattere del soggetto, stato emotivo,
livello di coscienza e di maturazione,
esperienza, contesto socio-culturale
ed economico di vita. Questo
secondo gruppo di variabili è quindi
più strettamente collegato all’interazione
tra paziente e terapia. Le variabili
soggettive sono quelle che determinano
l’atteggiamento del paziente
verso la terapia e ne condizionano le
azioni. Un bambino piccolo che rifiuti
di inghiottire una medicina perché
di sapore sgradevole può essere il
responsabile del probabile insuccesso
della terapia in seguito al suo comportamento.
Secondo una visione tradizionale
della medicina, il bambino
andrebbe forzato ad accettare ciò “che
non gradisce” pur di sortire l’effetto
desiderato. Al contrario, per ottenere
lo stesso risultato (curare il bambino),
un’ottica più centrata sul paziente tenderà
a modificare il prodotto per
migliorarlo, perché sia favorita l’aderenza
alla terapia (compliance).
La
scarsa aderenza alla terapia da parte
dei pazienti è una causa frequente di
insuccesso terapeutico. In molti casi è
riconducibile ad una carenza del prodotto/terapia che crea un disagio al
paziente e lo induce al rifiuto.
Aumentare la compliance del paziente
verso la terapia è quindi uno degli
obiettivi dell’innovazione farmaceutica
e rientra nel concetto di “patient
care”. Tra gli altri obiettivi vi sono
l’aumento dell’efficacia e riduzione
degli effetti collaterali delle terapie, la
riduzione dell’invasività delle somministrazioni.
L’innovazione può realizzarsi
in ogni stadio della filiera
farmaceutica che dall’idea iniziale
culmina con il prodotto nelle mani del
paziente, passando attraverso il design
(drug discovery & drug delivery), la
fabbricazione industriale (Quality
Assurance) e la distribuzione (comunicazione,
farmacovigilanza). In particolare,
l’innovazione tecnologica si
realizza ricercando nuove forme di
dosaggio per principi attivi già in uso
e/o sfruttando vie di somministrazione
diverse dalle classiche per os o iniettiva.
La forma farmaceutica diventa
così un elemento integrante e imprescindibile
del medicinale. Innovativi
sono, ad esempio, i prodotti combinati:
“combinare” significa 1) associare
due o più molecole attive all’interno
delle stessa singola unità di dosaggio
(compressa, capsula), oppure 2)
costruire medicine in cui la formulazione
sia corredata dal dispositivo
necessario per la somministrazione (es.
prodotti inalatori, siringhe monouso
pre-dosate). Prodotti concepiti in questo
modo diventano adattabili alle esigenze
dei pazienti e sono quindi personalizzabili
per categorie di pazienti,
tra le quali bambini, anziani, etc.
In ultima analisi, è chiaro come il concetto
di “personalizzazione delle terapie”
possa assumere connotazioni
diverse, ma tutte sono da considerarsi
altrettanto valide: in certi casi una
medicina personalizzata sarà una
molecola attiva che è stata studiata ad
hoc conoscendo il corredo genetico
del paziente (farmacogenomica) e che
quindi è adatta al suo corpo come
entità biologica per massimizzare l’efficacia
e ridurre gli effetti secondari. In
altri casi, la medicina personalizzata
sarà un prodotto finito adatto al
paziente che è sì dotato di un corpo
(da curare), ma anche di una sfera
cognitiva ed emotiva che influenzano
l’esito della terapia. Dovrà quindi essere
un prodotto adatto all’utilizzo/somministrazione
in ciascun paziente,
facile da usare e gradito (maggiore
compliance = minore rischio di errori),
per un esito complessivo della terapia
che sia, come nel caso precedente,
ottimale.
Piattaforma tecnologica
Dome Matrix®
Negli ultimi anni sempre più principi
attivi (p.a.) sono presentati in una
forma di dosaggio che ottimizzi le loro
proprietà terapeutiche. Dapprima le
forme farmaceutiche erano disegnate
per assicurare un rilascio prolungato
nel tempo del p.a. per mantenere a
lungo concentrazioni ematiche attive,
riducendo gli effetti collaterali ed il
numero di somministrazioni. Nel ventunesimo
secolo, nuove esigenze si
sono imposte come ad esempio la personalizzazione
della dose da somministrare,
l’associazione di più p.a. nella
stessa forma di dosaggio, un rilascio
versatile del p.a. dalla formulazione,
rilascio che possa essere controllato sia
in senso temporale che spaziale, privilegiando
particolari sedi anatomiche.
In questo contesto, l’Università di
Parma ha sviluppato una piattaforma
tecnologica innovativa per la formulazione
ed il rilascio di farmaci somministrati
per via orale (oggetto di 2 brevetti).
La piattaforma si basa sul concetto
“dell’assemblaggio di moduli di
rilascio di farmaco”.
I moduli Dome
Matrix®, concettualmente simili a
piccoli mattoncini LEGO, vengono
costruiti con forma geometrica e
dimensioni tali da poterli combinare
tra loro per costruire il sistema assemblato
(prodotto finito) destinato alla
terapia. Da tale sistema assemblato il/i
principio/i attivo/i in esso contenuto/i
sarà liberato (rilascio) nel tempo e/o
nello spazio secondo una modalità che
senz’altro dipende dalle caratteristiche
intrinseche del singolo modulo, ma
anche e soprattutto da come i moduli
sono stati combinati a costituire l’entità
singola assemblata.
Il modulo singolo Dome Matrix® è
di fatto una compressa a forma di
disco le cui due basi, anziché piatte,
sono una concava e l’altra convessa
(Figura 1).
In virtù della sua forma e
del materiale/i di cui è costituito, il
modulo (chiamato anche unità di rilascio)
esibisce una propria cinetica di
rilascio del p.a., cioè libera il p.a. in
esso incorporato con una velocità programmata
(e programmabile).
La particolare forma del modulo è poi
funzionale alla fase di assemblaggio.
Nel momento in cui due o più moduli
contenenti lo stesso p.a. sono assemblati
tra loro, si ottiene un “sistema
solidale modulare” che consente un
rilascio del p.a. nel tempo e nello spazio
dipendente da come i moduli sono
stati combinati.
Infatti, i moduli di
rilascio possono essere assemblati in
due configurazioni tipiche, denominate
void (a camera vuota) e stacked
(impilata). La configurazione void
(Figura 2) si costruisce assemblando
per incastro due moduli (tra loro leggermente
diversi come geometria) con
la faccia concava del primo rivolta
verso la faccia concava del secondo.
Si
tratta di un semplice meccanismo di
incastro simile a quello di chiusura di
un bottone automatico che, per il
design peculiare dei due moduli
(maschio e femmina), non richiede
passaggi di saldatura o incollaggio. Il
sistema assemblato così ottenuto è in pergrado
di galleggiare sulla superficie
dell’acqua grazie alla camera d’aria che
con l’assemblaggio si è creata all’interno
del sistema. Il galleggiamento persiste
finché il sistema non venga completamente
disciolto distruggendo la
camera d’aria. Tale capacità di galleggiare
può essere sfruttata per avere un
rilascio controllato del p.a. dal sistema
nello stomaco: infatti, fintanto che
nello stomaco è presente liquido per
galleggiare, il sistema galleggiando
avrà minore probabilità di essere trasferito
nell’intestino e più tempo per
rilasciare p.a. nello stomaco. Questo
può migliorare l’outcome ad esempio
di terapie con principi attivi che siano
assorbiti meglio nello stomaco o nella
prima parte del tratto intestinale.
Uno
studio pilota di gamma scintigrafia
condotto su 10 volontari (5 maschi e
5 femmine) ha dimostrato come l’assemblato
void caricato con un tracciante
galleggiasse sulla superficie del
contenuto gastrico fin dal suo arrivo
nello stomaco. Nello studio i pazienti
assumevano un assemblato galleggiante
e, in seguito, un sistema non galleggiante
avente ugual peso e composizione.
E’ stato così possibile osservare
come i tempi di permanenza nello stomaco
del prodotto non galleggiante
(96.7 min ± 27.3) e dell’assemblato
galleggiante (214.5 min ± 54.2) fossero
statisticamente diversi, provando
l’effettiva gastro-ritenzione dell’assemblato void.
La stessa configurazione void può
essere proposta per un rilascio colonspecifico,
ossia per far arrivare al colon
un p.a. destinato ad un’azione locale
in quella sede, passando “indenne”
stomaco e intestino tenue. Ciò è fattibile
allorché la cavità venga riempita
con il p.a. in questione che, protetto
dai due moduli, non entra in contatto
con i fluidi gastrici ed intestinali finché
il sistema assemblato void mantiene
la propria integrità.
Se il sistema void è utile per il controllo
spaziale del rilascio di p.a., la conformazione
impilata (stacked) permette
invece un controllo di tipo temporale.
Qui l’assemblaggio di 2 o più
moduli uno sopra l’altro avviene inserendo
la base convessa di uno nella
concavità del successivo. Nella versione
più semplice in cui i moduli impilati
siano tra loro identici, ciò che
cambia passando dal modulo singolo
alla pila è la velocità di liberazione del
p.a. dal sistema (cinetica di rilascio).
Quantitativamente, l’effetto sulla
cinetica di rilascio dipende da quanti
moduli sono stati assemblati, quindi
dalla nuova geometria del sistema: la
cinetica diminuisce all’aumentare del
numero di moduli impilati.

Un ulteriore
elemento di versatilità di questa
configurazione è legato al fatto che
ogni modulo nella pila può contenere
un p.a. diverso dall’altro: questo perdell’assemmette
di riunire in una sola unità di
dosaggio più principi attivi utilizzati
in una terapia complessa, superando
eventuali incompatibilità di tipo chimico
e riducendo inoltre le somministrazioni
per il paziente.
In che modo l’innovazione offerta
dalla tecnologia Dome Matrix® può
rispondere alle esigenze di personalizzazione
delle terapie? Il crescente utilizzo
di più farmaci insieme per trattare
patologie croniche tipiche della
popolazione occidentale che invecchia,
mette oggi in risalto l’importanza
di poli-terapie farmacologiche.
Si
tratta di terapie in cui la contemporanea
assunzione di farmaci diversi è
necessaria per combattere o stabilizzare
la malattia e prevenire gli effetti collaterali.
Spesso la posologia è complessa,
i farmaci sono assunti in momenti
diversi, cosa che rende la terapia di difficile
gestione da parte del paziente,
soprattutto quando egli sia anziano,
solo oppure mentalmente compromesso.
Il sistema assemblato è una
risposta al bisogno di semplificare la
posologia per il bene del paziente, perché
la forma di dosaggio comprende
tutto quanto serve in un’unica somministrazione:
dosi precise di molecole
diverse sono somministrate in contemporanea
attraverso un’unica forma
di dosaggio e, eventualmente, rilasciate
con modalità differenti perché inserite
in moduli diversi dello stesso sistema assemblato.
Un altro campo di applicazione della
tecnologia è nella terapia della malaria
nei paesi in via di sviluppo. I protocolli
terapeutici consigliati dall’OMS
per combattere la malaria prevedono
l’associazione di almeno due o più
molecole da somministrare simultaneamente
per avere maggiore efficacia
e contrastare l’insorgenza di resistenze.
Ciò rende complesse le terapie in relazione
al numero di farmaci da assumere.
Questo si inserisce in contesti
economico-sociali in cui le strutture
sanitarie che dispensano i farmaci
sono poco numerose, a volte lontane
dai luoghi di residenza degli ammalati,
che non sempre possono recarvisi,
per cui le cure devono essere portate a
loro. La situazione in cui i pazienti
combattono con la malattia è di
povertà, scarsa igiene, privazioni: tutto
ciò genera uno stato complessivo di
disagio per il paziente che senz’altro
potrebbe beneficiare di uno strumento
terapeutico efficace e adattabile
anche a condizioni estreme di gestione
della terapia.
Su queste premesse, applicando la tecnologia
Dome Matrix®, è in fase di
sviluppo un “sistema terapeutico
multi-cinetico e sito specifico” per
somministrazione in combinazione di
farmaci antimalarici (malaria da
Plasmodium Falciparum).
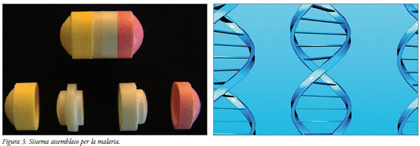
L’associazione di principi attivi scelta
per la costruzione di questo sistema
terapeutico è quella Artesunato -
Clindamicina. Il sistema terapeutico
progettato consta di quattro moduli
da assemblare nel modo seguente per
costituire l’unità di somministrazione
(Figura 3):
1.due moduli a rilascio controllato
contenenti ciascuno 1/3 della dose
totale di clindamicina uniti in configurazione
void (modulo panna e
modulo bianco). Questa porzione di
assemblato è destinata a rimanere il
più possibile nello stomaco galleggiando,
riducendo così gli effetti collaterali
che si avrebbero se tutta la dose di
p.a. fosse rilasciato nel colon;
2.un modulo a rilascio immediato
contenente 1/3 della dose di clindamicina
(modulo giallo);
3.un modulo a rilascio immediato
contenente la dose intera di artesunato
(modulo rosa).
La suddivisione della dose di clindamicina
nei vari moduli è voluta affinché
1/3 di essa si liberi subito dopo la
somministrazione (rilascio immediato)
e i restanti 2/3 siano liberati con
velocità prestabilita (rilascio controllato).
Questo dovrebbe permettere di
raggiungere rapidamente concentrazioni
plasmatiche attive e di mantenerle
nel tempo grazie ai moduli a rilascio controllato, prolungando l’attività.
Tutto l’artesunato è invece formulato
per averne il rilascio immediato. In
studi in vitro, questo sistema ha dimostrato
la capacità di liberare la dose di
artesunato ed il primo terzo di quella
di clindamicina in circa 2 minuti
dopo immersione in acqua. Di
seguito, la porzione di assemblato void
inizia a galleggiare e rilasciare in modo
controllato il resto della dose di
clindamicina.
Altri case studies sono stati finora
affrontati con la tecnologia Dome
Matrix® dimostrando come la sua
modularità sia in grado di adattarsi
facilmente a diverse applicazioni.
La tecnologia di assemblaggio dei
moduli di rilascio, denominata Dome
Matrix®, rappresenta dunque un’alternativa
alle esistenti tecnologie per la
somministrazione in maniera controllata
di principi attivi tradizionali e/o
biotecnologici. Essa consente di fabbricare
industrialmente prodotti che
presentino una cinetica di rilascio versatile,
una personalizzazione della dose
somministrata oppure l’associazione
di farmaci diversi in una singola unità.
La riduzione nel numero di ospedalizzazioni
conseguenti alla errata assunzione
di farmaci è un obiettivo concreto
di farmaco-economia. La corretta
assunzione dei farmaci nei pazienti
anziani che abitualmente assumono numerosi prodotti per la cura di
malattie croniche, può essere favorita
con un prodotto che combini più
sostanze in una sola unità. Solo negli
Stati Uniti è stato calcolato che la risoluzione
di questo problema assicurerebbe
un risparmio di circa un miliardo
di dollari l’anno. Il problema è
stato affrontato anche dalla FDA nel
2004 che ha rilasciato alcune linee
guida per i prodotti farmaceutici in
combinazione.
Un’altra necessità cui è possibile far
fronte è quella delle terapie complesse
come quelle per la cura dell’AIDS,
tubercolosi, morbo di Parkinson e
neoplasie, che vengono affrontate con
associazioni di più farmaci secondo
complicati schemi posologici.
In conclusione, appare evidente
come il fatto di sottoporre il paziente
ad una terapia non possa più essere
considerato come un semplice “avvitare
un bullone per aggiustare un
motore”. La terapia e il medicinale interagiscono con il paziente a vari
livelli ed il paziente è una persona che
reagisce alla terapia con risposte che
non sono solo di natura biologica.
Pertanto, l’esito della terapia sarà fortemente
dipendente dal livello di
attenzione che viene offerta al paziente,
non solo sotto forma di assistenza
fisica da parte di altre persone, ma
anche attraverso gli strumenti adoperati
per curarlo (medicinali, strumenti
diagnostici).
La malattia è uno
stato di sofferenza e di infelicità per la
persona: come tale richiederà il trattamento
adeguato, ma ancor più partecipazione,
condivisione e attenzione
per chi, trovandosi nel disagio, ha
bisogno e si aspetta di essere accudito
con tutti i mezzi possibili.
Pubblicazioni tecnico-scientifiche
1. Assemblage of novel release modules for
the development of adaptable drug delivery
systems. Losi E., Bettini R., Santi
P., Sonvico F., Colombo G., Lofthus K.,
Colombo P., Peppas N.A. J Control
Release 2006, 111(1-2): 212-8
2. New modules, new assemblage kits and
new assemblies for the controlled release
of substances. P. Colombo, P. Santi, R.
Bettini, O.L. Strusi, F. Sonvico, G.
Colombo. PCT/EP/2006/011661,
December 5, 2006
3. Module assemblage technology for floating
systems: in vitro flotation and in
vivo gastro-retention, Strusi O.L.,
Sonvico F., Bettini R., Santi P.,
Colombo G., Barata P., Oliveira A.,
Santos D., Colombo P. J Control
Release 2008, 129(2):88-92
4. Tapioca starch graft copolymers and
Dome Matrix modules assembling
technology. I. Effect of module shape
on drug release, Casas M., Strusi O.L.,
Jiménez-Castellanos M.R., Colombo P.
Eur J Pharm Biopharm 2010, 75(1):42-
7.