

L’ictus è la terza causa di morte (dopo tumori ed infarto cardiaco) e la prima causa di disabilità nel mondo. Il trattamento mirato e rapido dell’ictus è un fattore estremamente importante per ridurre la mortalità e la disabilità conseguente all’ictus ischemico acuto (IIA). Poiché la causa principale dell’IIA è rappresentata dalla occlusione di un vaso cerebrale da parte di un trombo, la terapia medica di tale malattia è la trombolisi con tPA (attivatore tissutale del plasminogeno) per via endovenosa, effettuata entro le 4 ore e mezza dall’esordio dei sintomi. Tale terapia consente la rottura del trombo con meccanismo farmacologico.
La sonotrombolisi (ST) è un nuovo
intervento terapeutico, che consiste
nella rottura del trombo grazie all’intervento
di ultrasuoni. Studi sperimentali
e clinici hanno dimostrato
l’effettiva capacità degli ultrasuoni,
applicati con una sonda appoggiata
sul cranio, di intensificare il processo
trombolitico. Un recente trial multicentrico
di fase II (CLOTBUST), ha
dimostrato che il doppler transcranico,
applicato con frequenze identiche
a quelle utilizzate nella pratica diagnostica
(2 MHz), potenzia l’azione
del farmaco t-PA, aumentando il tasso
di ricanalizzazione arteriosa nell’ictus
acuto. Gli ultrasuoni determinano
infatti un aumento delle turbolenze di
flusso intorno al trombo (“microstreaming”)
promuovendo così il “mescolamento”
del sangue stesso con il
t-PA, e, quindi, aumentando la concentrazione
di trombolitico che viene
a contatto con il trombo. Le onde
di pressione generate dagli ultrasuoni
possono, inoltre, incrementare la
penetrazione del t-PA nelle maglie
di fibrina ed aumentare il legame del
tPA con la fibrina. Recentemente, è
stato inoltre evidenziato che l’associazione
degli ultrasuoni con microbolle
gassose (figura 1) intensifica
ulteriormente l’effetto dei soli ultrasuoni
sulla trombolisi, con aumento
della ricanalizzazione del vaso arterioso
occluso e quindi miglioramento
clinico dei pazienti. La cosiddetta
sonotrombolisi potenziata dall’uso
di microbolle (MB) è, quindi, una
nuova e promettente terapia dell’ictus
ischemico acuto. Le microbolle contenute
nei mezzi di contrasto diagnostici
sono delle microsfere costituite
internamente da aria o gas ed esternamente
da un guscio di fosfolipidi.
L’applicazione degli ultrasuoni crea
un cambiamento nella conformazione
della bolla, ponendola dapprima
in risonanza e quindi portando alla
rottura finale della bolla stessa, con
conseguente liberazione di energia
meccanica. L’applicazione degli ultrasuoni
nella sede dell’occlusione causa
dei cambiamenti nella struttura del
trombo, disorganizzando le maglie di
fibrina e facilitando l’entrata, all’interno
del trombo, del farmaco trombolitico
e delle microbolle; queste,
nel momento della “esplosione” facilitano
ulteriormente la rottura della
rete di fibrina e, quindi, la successiva
disgregazione del trombo. Si può
quindi concludere che la distruzione
delle MB, determinata dagli ultrasuoni,
potenzia la dissoluzione del trombo.
Poiché le microbolle possiedono,
già da sole, un’intrinseca capacità di
frammentare il coagulo anche in assenza
di trombolitico, la loro attivazione
potrebbe creare un danno endoteliale
e facilitare micro-rotture del
vaso, con successiva trasformazione
emorragica dell’ictus ischemico.
La trasformazione emorragica di un
infarto cerebrale si verifica nel 30-40%
circa di tutti gli infarti ed avviene di
solito nei primi 3-10 giorni dall’ictus.
Nella grande maggioranza dei casi
il sanguinamento è modesto e privo
di significato clinico, ma nel 2-10%
dei casi gli infarti sopratentoriali vanno
incontro ad una trasformazione
emorragica massiva, spesso indistinguibile
da un’emorragia cerebrale.
L’evento può provocare un peggioramento
del deficit neurologico,
una compromissione dello stato di
coscienza o addirittura il decesso. Il
rischio di trasformazione emorragica
è più elevato quando l’infarto è di origine
cardioembolica, soprattutto se
l’area ischemica è vasta. L’estensione
della trasformazione emorragica può
variare ampiamente, da un piccolo
infarcimento emorragico petecchiale
(HI) ad un esteso ematoma parenchimale
(PH), con compressione sul
tessuto cerebrale circostante (“effetto
massa”). Nel primo caso non vi è
alcuna conseguenza negativa sui sintomi
del paziente (anzi, è indice di
maggiore ricanalizzazione del vaso),
mentre nel secondo caso l’emorragia
comporta un peggioramento del quadro
clinico, che può anche giungere al
decesso del paziente stesso.

Figura 1. Microbolla rivestita di fosfolipidi
Lo scopo
della presente ricerca è stato quello
di valutare il rischio di trasformazione
emorragica in pazienti con ictus
acuto (< 6 h) trattati con sonotrombolisi
potenziata da microbolle. Abbiamo
selezionato pazienti con ictus
acuto giunti alla nostra osservazione
entro 6 ore dall’insorgenza dei sintomi.
In un gruppo di 480 pazienti,
valutati prospetticamente, con occlusione
dell’arteria cerebrale media, sia prossimale che distale, sono stati
selezionati 188 pazienti, trattati con
t-PA, ultrasuoni e microbolle. Questi
pazienti sono stati paragonati con un
gruppo di controllo storico di 98 pazienti
con occlusione di ACM e trattati
con solo t-PA e.v. più ultrasuoni,
ma senza microbolle. I pazienti hanno
ricevuto sonotrombolisi continua
per 2 ore associata a tre boli e.v. di
mezzo di contrasto diagnostico (Levovist)
con microbolle (2.5 g) somministrate
ai minuti 2, 20 e 40 dopo
l’infusione di tPA (gruppo MB). I
pazienti arruolati sono stati paragonati
con 98 pazienti di controllo
storico (gruppo di controllo), affetti
da ictus ischemico acuto trattato con
sonotrombolisi (t-PA + monitoraggio
di 2 ore con US senza microbolle).
I pazienti sono stati poi sottoposti a
valutazioni neurologiche seriate, mediante
la scala NIHSS ed a doppler
di controllo, per verificare la presenza
di ricanalizzazione alle ore 2, 6, 12 e
24 dopo l’infusione di t-PA. La presenza
e l’estensione della trasformazione
emorragica sono state valutate
sulla TC delle 24 ore e classificate in
infarto emorragico (HI) ed ematoma
parenchimale (PH).
Figura 2. t-PA+US+MB nella sede del trombo
Risultati.
I tassi di ricanalizzazione
arteriosa sono stati più alti nel gruppo
di pazienti trattati con le microbolle
rispetto ai controlli (vedi grafico). La
somministrazione di MB è stata associata
con un aumentato rischio di infarto
emorragico asintomatico (21%
vs 12%, p = 0.026) e con un alto grado
di miglioramento clinico alle 24
ore (54.9% vs 31.1%, p = 0.004)
Le
percentuali di ematoma parenchimale
ed emorragia intracranica sintomatica
erano simili in entrambi i gruppi,
quindi non influenzate dalla somministrazione
di microbolle. Inoltre,
l’estensione del sanguinamento era
correlata con il tempo di riperfusione.
La ricanalizzazione precoce si è rivelata
predittore indipendente di infarto
emorragico, ma non di ematoma parenchimale,
nel gruppo MB (odds ratio
6.3, 95% confidence interval 2.3-
56) ma non nel gruppo di controllo.
Questo significa che la presenza di
MB influenza la possibilità di presentazione
del benigno infarcimento
emorragico ma non di ematoma parenchimale.
In conclusione, l’estensione
del sanguinamento post-sonotrombolisi
con microbolle è correlata
con il profilo temporale della riperfusione.
La somministrazione di MB è
associata con una ricanalizzazione arteriosa
precoce, con una maggior frequenza
di infarcimento emorragico
asintomatico e con un miglioramento
clinico alle 24 ore.
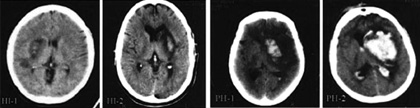
Trasformazione emorragica
Conclusioni.
Nella presente ricerca,
il trattamento dell’ictus ischemico
acuto con MB ha aumentato di sei
volte la possibilità di infarcimento
emorragico, associandosi con una
ricanalizzazione precoce dell’arteria
occlusa. È possibile, quindi, affermare
che l’infarcimento emorragico
“benigno” è stato un marcatore di
ricanalizzazione precoce che, notoriamente,
è associata ad una buona
prognosi clinica. Inoltre, l’utilizzo di
sonotrombolisi potenziata da microbolle,
aumentando la penetrazione di
tPA nel trombo, potrebbe permettere,
future ricerche incentrate su:
- abbassare la dose di tPA stesso, riducendo,
quindi, il rischio degli
effetti collaterali legati alla somministrazione
di questo farmaco.
L’utilizzo di una bassa dose di farmaco
potrebbe, inoltre, permettere
di aumentare il numero di pazienti
candidati a questo trattamento, in
maggior sicurezza;
- trattare anche pazienti che presentano
controindicazioni alla somministrazione
di tPA, essendo già
dimostrata la capacità degli ultrasuoni
di agire anche in assenza del
tPA stesso. Questi pazienti restano
attualmente esclusi dai trattamenti
più innovativi della fase acuta;
- trattare pazienti anche oltre l’attuale
finestra terapeutica delle 4 ore
e mezza. Una finestra terapeutica
così ristretta riduce, di fatto, la possibilità
per molti pazienti di beneficiare
di questo trattamento;
- sperimentare, da un punto di vista clinico, l’utilizzo di microbolle “ripiene” di farmaco trombolitico, con adesione selettiva a componenti del trombo.
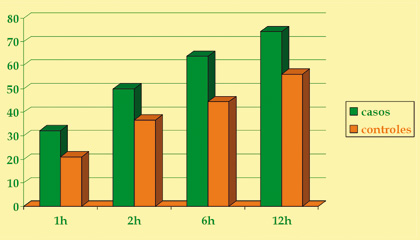
Tassi di ricanalizzazione arteriosa in relazione al timing
Questo trattamento, ultra-innovativo,
permetterebbe di rendere focalizzata
e ridotta la quantità di farmaco trattamento
mirato sul trombo. L’insieme delle
prospettive aperte da questo studio
consiste nell’aumentare il numero di
pazienti potenzialmente trattabili con
terapie innovative, di dimostrata efficacia
e sicurezza.
Questo è particolarmente importante
per una malattia che è tra le più frequenti
nei paesi industrializzati e che,
con l’incremento dell’età media, è destinata
a crescere ulteriormente.
Dato anche l’aumentato benessere
della popolazione, appare corretto offrire
l’opportunità di un trattamento
esteso che permetta un recupero della
qualità di vita di questi pazienti.
C’è da ricordare, infine, che ogni
anno in Italia su un totale di circa
200.000 nuovi ictus, 4.200 colpiscono
persone di età inferiore a 45 anni
e 6.200 di età compresa tra 45 e 55
anni.
La sonotrombolisi con MB rappresenta,
quindi, un’ulteriore opportunità
terapeutica per il non esiguo numero
di giovani pazienti in età lavorativa
che vengono colpiti da questa patologia,
spesso gravemente invalidante,
con rilevanti conseguenze in ambito
familiare e sociale.
Bibliografia
- Tsivgoulis G, Alexandrov AV. Ultrasound- enhanced thrombolysis in acute ischemic stroke: potential, failures, and safety. Neurotherapeutics. 2007 Jul;4(3):420-7. Review.
- Molina CA, Ribo M, Rubiera M et al. Microbubble administration accelerates clot lysis during continuous 2-MHz ultrasound monitoring in stroke patients treated with intravenous tissue plasminogen activator. Stroke. 2006 Feb; 37(2):425-9. Epub 2005 Dec 22.
- Unger EC, Matsunaga TO, McCreery T, Schumann P, Sweitzer R, Quigley R.
Therapeutic applications of microbubbles. Eur J Radiol. 2002 May; 42(2):160-8. - Dijkmans PA, Juffermans LJ, Musters RJ, van Wamel A, ten Cate FJ, van Gilst W, Visser CA, de Jong N, Kamp O Microbubbles and ultrasound: from diagnosis to therapy. Eur J Echocardiogr. 2004 Aug; 5(4):245-56
- Meairs S., Alonso A. Ultrasound, microbubbles and the blood-brain barrier. Progress in Biophysics and Molecular Biology 93 (2007) 354-362
- Berger et al. Hemorrhagic transformation of ischemic brain tissue: asymptomatic or symptomatic? Stroke. 2001; 32:1330-1335
- Alexandrov AV, Molina CA, Grotta JC, Garami Z, Ford SR, Alvarez-Sabin J, Montaner J, Saqqur M, Demchuk AM, Moyé LA, Hill MD, Wojner AW, for the CLOTBUST Investigators. Ultrasound- enhanced thrombolysis for acute ischemic stroke. N Engl J Med 2004; 351:2170-2178.