Dalla diagnostica alle terapie mirate La medicina di precisione rappresenta un importante passo avanti nella cura della leucemia acuta mieloide, un tumore relativamente raro, che registra in Italia circa tremila nuovi casi ogni anno. La medicina di precisione rappresenta un importante passo avanti nella cura della leucemia acuta mieloide, un tumore relativamente raro, che registra in Italia circa tremila nuovi casi ogni anno.
Di Francesco Lo Coco, Tiziana Ottone, Dipartimento di Biomedicina e Prevenzione Università Tor Vergata, Roma
La Leucemia Acuta Mieloide (LAM) è una neoplasia del tessuto emopoietico a decorso aggressivo, caratterizzata dall’espansione di precursori immaturi dei globuli bianchi, che si accumulano nel midollo osseo, nel sangue periferico e in altri tessuti causando uno scompenso funzionale nella normale emopoiesi. La crescita incontrollata di cellule indifferenziate produce, oltre a infiltrazione diffusa nell’organismo di cellule tumorali, anemia, tendenza a fenomeni emorragici e facilità a contrarre infezioni, dovute alla scarsa produzione di globuli bianchi funzionanti. La LAM è considerata un tumore relativamente raro: in Italia si stima che vengano diagnosticati circa tremila nuovi casi ogni anno.
Nonostante le cause non siano del tutto note, determinati fattori, come l’esposizione al benzene, le radiazioni ionizzanti e alcuni chemioterapici e/o la radioterapia utilizzate per la cura di altri tipi di tumore, possono favorirne l’insorgenza. Sebbene gli schemi di chemioterapia attualmente in uso producano un’apparente guarigione in circa il 70% dei casi, la maggior parte dei pazienti con LAM, e soprattutto quelli in cui non è possibile ricorrere al trapianto di cellule staminali da donatore compatibile, vanno incontro a ricaduta entro i primi due anni dalla iniziale remissione a causa dell'espansione di cellule resistenti ai trattamenti convenzionali.
Il tasso di risposta alle terapie è maggiore nei pazienti di età inferiore ai 60 anni (con guarigioni intorno al 50%-60% dei casi) mentre per i pazienti di età più avanzata i dati di risposta a lungo termine sono ancora molto scoraggianti, con tassi di sopravvivenza oltre i 5 anni che non superano il 15-20%. La LAM rimane pertanto, ancora oggi, una neoplasia difficile da eradicare, soprattutto nel gruppo di pazienti che definiamo ad alto rischio di recidiva. Vi è inoltre da osservare che, nonostante la malattia possa essere diagnosticata in tutte le fasce di età (essendo però molto rara nei bambini, e più frequente in giovani adulti e anziani), l’età mediana dei pazienti al momento della diagnosi è piuttosto avanzata (intorno ai 65-70 anni). Ne deriva che una gran parte dei pazienti spesso presenta comorbidità di vario tipo, come ad esempio una ridotta funzionalità cardiaca, epatica o renale, e dunque questa categoria potrà frequentemente mostrare scarsa o diminuita tolleranza alla chemioterapia convenzionale e/o alle procedure trapiantologiche.
Dal punto di vista biologico, la LAM è una neoplasia molto eterogena e pertanto, anche considerando che alcune varietà della malattia non sono ancora ben caratterizzate, essa rappresenta una patologia di crescente interesse scientifico. Il sospetto diagnostico della LAM si basa dapprima sul quadro clinico del paziente e si conferma in seguito con indagini di laboratorio, in particolar modo con l’analisi morfologica al microscopio, immunofenotipica (tramite metodiche di citofluorimetria a flusso) e genetico-molecolare di campioni di sangue midollare e venoso.
 È bene ricordare che queste metodiche di laboratorio non sono alternative l’una all’altra, ma dovranno bensì essere tutte comprese nel corretto approccio diagnostico alla malattia. Infatti, soltanto una diagnostica integrata che includa analisi morfologica, immunofenotipica, citogenetica e molecolare potrà permettere una definizione precisa del sottotipo specifico di LAM e offrire le migliori opportunità terapeutiche ai pazienti. Come dimostrano i moderni sistemi classificativi, ad esempio quello della organizzazione mondiale della sanità (WHO), oggi sappiamo che in realtà sotto la definizione di LAM si deve comprendere un’ampia varietà di forme leucemiche che occorre distinguere bene l’una dall’altra. Questo perché diverso è il comportamento clinico ed in particolare il grado di aggressività delle varie forme, così come differente è la sensibilità di risposta alle varie terapie oggi disponibili, in relazione alle caratteristiche fenotipiche e molecolari delle cellule leucemiche. È bene ricordare che queste metodiche di laboratorio non sono alternative l’una all’altra, ma dovranno bensì essere tutte comprese nel corretto approccio diagnostico alla malattia. Infatti, soltanto una diagnostica integrata che includa analisi morfologica, immunofenotipica, citogenetica e molecolare potrà permettere una definizione precisa del sottotipo specifico di LAM e offrire le migliori opportunità terapeutiche ai pazienti. Come dimostrano i moderni sistemi classificativi, ad esempio quello della organizzazione mondiale della sanità (WHO), oggi sappiamo che in realtà sotto la definizione di LAM si deve comprendere un’ampia varietà di forme leucemiche che occorre distinguere bene l’una dall’altra. Questo perché diverso è il comportamento clinico ed in particolare il grado di aggressività delle varie forme, così come differente è la sensibilità di risposta alle varie terapie oggi disponibili, in relazione alle caratteristiche fenotipiche e molecolari delle cellule leucemiche.
Sebbene l’analisi del cariotipo (o esame dell’assetto cromosomico) delle cellule leucemiche rimanga uno dei fattori prognostici principali per la risposta alla terapia, durante gli ultimi anni sono state identificate una serie di mutazioni a carico di geni implicati nella trasformazione neoplastica, rilevabili solo attraverso particolari tecniche di biologia molecolare. La caratterizzazione di queste alterazioni geniche è importantissima non solo per spiegare meglio come si sviluppa la malattia, e cioè per comprendere la patogenesi della LAM, ma ha anche un rilevante significato da un punto di vista clinico. Alcune mutazioni genetiche rappresentano infatti dei veri e propri marcatori prognostici, associandosi ad andamento più o meno aggressivo della malattia, ed in molti casi esse rappresentano bersagli terapeutici ed hanno portato allo sviluppo di nuove terapie mirate. Fondamentale ai fini di identificare queste alterazioni delle cellule leucemiche, è stato l’avvento recente di tecnologie biomolecolari molto avanzate come il Next Generation Sequencing, con la possibilità di sequenziare l’intero genoma cellulare.
L’innovazione tecnologica applicata alla biologia cellulare, accompagnata dallo sviluppo di test genetici rapidi e affidabili, permette oggi all’ematologo di accedere a rapidi saggi diagnostici assai affidabili e in molti casi di mettere in atto strategie terapeutiche mirate. L’utilizzo di queste nuove tecnologie deve comunque essere sempre integrato, come già detto sopra, dalle altre procedure diagnostiche (morfologia, citofluorimetria, citogenetica) al fine di classificare il paziente secondo le più recenti linee guida internazionali. Nasce da qui il concetto di “medicina di precisione” che, sulla base della forte variabilità genetica tra i pazienti oncologici, individua terapie e cure sempre più specifiche. Un importante risultato nel campo della medicina di precisione è senza dubbio rappresentato dalla Leucemia Acuta Promielocitica (LAP). Questa varietà di LAM si presenta spesso con gravi fenomeni emorragici e si accompagna a un alto rischio di mortalità precoce, soprattutto se non diagnosticata e trattata in modo tempestivo.
L’andamento di questa patologia cambia in modo radicale con l’instaurarsi di una terapia mirata (diretta contro la proteina di fusione PML/RARA, specifica per questa malattia) che oggi consente di guarire circa il 90% dei pazienti. Ciò è stato dimostrato grazie ad uno studio coordinato in Italia dal GIMEMA (Gruppo Italiano per lo studio delle Malattie Ematologiche dell'Adulto) e condotto in collaborazione a ricercatori tedeschi, ed i cui risultati sono stati pubblicati pochi anni fa sul New England Journal of Medicine (NEJM). La combinazione di due farmaci diretti verso il bersaglio biologico della LAP, e cioè l’acido all-trans retinoico (ATRA) e il triossido di arsenico (ATO), degradando la proteina anomala PML/ RARA, consente un vantaggio di sopravvivenza rispetto alla tradizionale combinazione di ATRA e chemioterapia, un risparmio di tossicità ed una maggiore efficacia della cura che a sua volta si associa ad un minore rischio di recidiva. Grazie allo studio menzionato, il triossido di arsenico è stato approvato dagli enti regolatori del farmaco, sia in Europa che negli USA, per la terapia di prima linea della LAP in pazienti che presentano malattia a rischio basso-intermedio (circa il 75% dei casi alla diagnosi).
Rispetto alla LAP, nelle altre forme di LAM l’impiego di terapie mirate verso specifici bersagli è ancora agli albori e fino allo scorso anno la chemioterapia ed il trapianto di cellule staminali, rappresentavano il trattamento di prima scelta per la gran parte dei pazienti. Oggi, grazie ad uno studio cooperativo internazionale, denominato “RATIFY”, alcuni pazienti possono usufruire di un farmaco innovativo, la Midostaurina, un agente selettivo che va a colpire specificamente le cellule di una forma di LAM particolarmente aggressiva. Approvata nel 2017, la Midostaurina in combinazione con la chemioterapia convenzionale, ha mostrato benefici clinici in termini di sopravvivenza per i pazienti caratterizzati dalla mutazione a carico del gene FLT3, marker biologico associato con un alto rischio di recidiva, presente in circa il 30% dei pazienti.
I risultati dello studio “RATIFY”, a cui ha dato un importante contributo il gruppo italiano GIMEMA, sono stati anche questi pubblicati sul New England Journal of Medicine (Stone et al, 2017). Ancora un altro esempio di terapia personalizzata nelle LAM è rappresentato dalla possibilità di utilizzare un farmaco mirato per i pazienti che presentano la mutazione IDH2 (Enasidenib). I risultati di uno studio clinico multicentrico denominato “AG221-C-001”, ha mostrato come l’uso di questo farmaco possa indurre risposte complete e durature in pazienti leucemici con mutazione del gene IDH2 e andati incontro a recidiva o resistenti al trattamento convenzionale. Questi dati, sono stati presentati al Congresso annuale dell’ASCO (American Society of Clinical Oncology) e sono stati recentemente pubblicati sulla rivista americana Blood (Stein et al., Blood 2017).
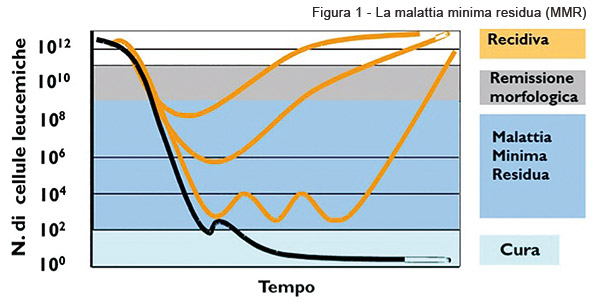
Se le nuove conoscenze cliniche e biologiche hanno permesso di ideare nuove strategie terapeutiche sempre più efficaci nelle LAM, purtroppo ancora un alto numero di pazienti affetti da LAM ricade a causa della persistenza di cellule neoplastiche residue dopo la terapia di induzione e/o consolidamento. Questa quota di cellule persistenti dopo la terapia si definisce con il termine di “malattia minima residua” (MMR). Il monitoraggio della MMR costituisce uno strumento essenziale per valutare la qualità della risposta alla terapia e delineare programmi post-remissionali basati sul rischio individuale di recidiva. Le metodiche di studio della MMR devono essere sensibili, specifiche, quantitative e di pratica applicabilità. Ad oggi, le due tecniche che consentono uno studio adeguato della MMR nella LAM sono la citofluorimetria multiparametrica e la biologia molecolare (in particolare la PCR) che con indagini quantitative permettono di misurare i livelli minimi di cellule tumorali presenti nel campione di sangue o di midollo osseo.
In conclusione, nonostante i significativi progressi ottenuti di recente nella terapia delle LAM, il problema della recidiva dopo la terapia iniziale, rappresenta ancora una delle sfide più rilevanti da affrontare per la ricerca in ambito oncoematologico. Ciò nonostante, come abbiamo detto sopra la medicina di precisione rappresenta un importante passo avanti nella cura delle LAM, e la recente approvazione di nuovi farmaci, sia pure ristretta soltanto ad alcune forme, lascia intravedere la possibilità di sensibili miglioramenti nella terapia personalizzata di questa leucemia. È pertanto auspicabile che, unitamente allo studio della MMR per la identificazione dei pazienti a maggior rischio di recidiva, nel prossimo futuro le terapie mirate consentano di migliorare sensibilmente l’approccio terapeutico e conseguentemente la prognosi dei pazienti affetti da LAM.
<< Torna indietro
|

 La medicina di precisione rappresenta un importante passo avanti nella cura della leucemia acuta mieloide, un tumore relativamente raro, che registra in Italia circa tremila nuovi casi ogni anno.
La medicina di precisione rappresenta un importante passo avanti nella cura della leucemia acuta mieloide, un tumore relativamente raro, che registra in Italia circa tremila nuovi casi ogni anno. È bene ricordare che queste metodiche di laboratorio non sono alternative l’una all’altra, ma dovranno bensì essere tutte comprese nel corretto approccio diagnostico alla malattia. Infatti, soltanto una diagnostica integrata che includa analisi morfologica, immunofenotipica, citogenetica e molecolare potrà permettere una definizione precisa del sottotipo specifico di LAM e offrire le migliori opportunità terapeutiche ai pazienti. Come dimostrano i moderni sistemi classificativi, ad esempio quello della organizzazione mondiale della sanità (WHO), oggi sappiamo che in realtà sotto la definizione di LAM si deve comprendere un’ampia varietà di forme leucemiche che occorre distinguere bene l’una dall’altra. Questo perché diverso è il comportamento clinico ed in particolare il grado di aggressività delle varie forme, così come differente è la sensibilità di risposta alle varie terapie oggi disponibili, in relazione alle caratteristiche fenotipiche e molecolari delle cellule leucemiche.
È bene ricordare che queste metodiche di laboratorio non sono alternative l’una all’altra, ma dovranno bensì essere tutte comprese nel corretto approccio diagnostico alla malattia. Infatti, soltanto una diagnostica integrata che includa analisi morfologica, immunofenotipica, citogenetica e molecolare potrà permettere una definizione precisa del sottotipo specifico di LAM e offrire le migliori opportunità terapeutiche ai pazienti. Come dimostrano i moderni sistemi classificativi, ad esempio quello della organizzazione mondiale della sanità (WHO), oggi sappiamo che in realtà sotto la definizione di LAM si deve comprendere un’ampia varietà di forme leucemiche che occorre distinguere bene l’una dall’altra. Questo perché diverso è il comportamento clinico ed in particolare il grado di aggressività delle varie forme, così come differente è la sensibilità di risposta alle varie terapie oggi disponibili, in relazione alle caratteristiche fenotipiche e molecolari delle cellule leucemiche.